
Un gruppo di ricercatori americani ha realizzato un nuovo sistema supramolecolare per la produzione “pulita” di idrogeno in grado di imitare il processo naturale della fotosintesi clorofilliana.
Il sistema è progettato per imitare le funzioni chiave del nucleo centrale responsabile della fotosintesi nelle piante verdi in modo da convertire l’energia solare in energia chimica conservandola sotto forma di combustibile idrogeno.
Trovare ispirazione dalla natura
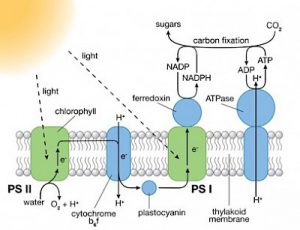
Le foglie delle piante verdi contengono centinaia di molecole di pigmenti (clorofilla e altri) che assorbono la luce corrispondente a determinate lunghezze d’onda. Quando la luce della giusta lunghezza d’onda colpisce una di queste molecole, la molecola entra in uno stato eccitato.
L’energia da questo stato eccitato viene trasportata lungo una catena di molecole di pigmenti fino a raggiungere un tipo specifico di clorofilla che si trova nel nucleo di reazione fotosintetica. A questo punto l’energia viene utilizzata per guidare il processo di separazione della carica necessaria affinché il processo di fotosintesi possa continuare.
La lacuna elettronica lasciata alle spalle della molecola di clorofilla è usata per la conversione dell’acqua in ossigeno. Gli ioni idrogeno che si formano durante il processo di scissione delle molecole d’acqua vengono infine utilizzati per la riduzione dell’anidride carbonica in glucosio nella seconda fase della fotosintesi, conosciuta come la reazione indipendente dalla luce.
La fotosintesi nelle piante verdi è un processo in grado di convertire l’energia solare in energia chimica trasformando l’anidride carbonica atmosferica e l’acqua in molecole di glucosio (zucchero) che alimentano la crescita delle piante.
La fotosintesi clorofilliana cattura quindi l’energia solare e la immagazzina sotto forma di energia chimica. Gli scienziati hanno cercato di replicare artificialmente questo processo di conversione dell’energia con l’obiettivo di produrre combustibili ecologici e sostenibili, come l’idrogeno e il metanolo. I ricercatori si sono resi conto di quanto fosse impegnativo cercare di imitare le funzioni chiave del nucleo della fotosintesi, la zona in cui le biomolecole specializzate effettuano la fotosintesi.
La fotosintesi artificiale richiede la progettazione di un sistema molecolare in grado di assorbire la luce, di separare la carica elettrica e trasportarla e catalizzare le reazioni responsabili della produzione di combustibile, tutti processi complicati che devono operare in maniera sincrona per raggiungere un’elevata efficienza di conversione dell’energia.
Cosa è stato fatto in laboratorio dai ricercatori
I chimici del Brookhaven National Laboratory e del Virginia Tech (USA) hanno progettato due fotocatalizzatori (materiali che accelerano le reazioni chimiche subito dopo aver assorbito la luce) che incorporano singoli componenti specializzati nell’assorbire la luce, separare la carica elettrica, effettuare la catalisi in una singola “supramolecola”. In entrambi i sistemi molecolari, più centri di raccolta della luce composti da ioni rutenio (RU) sono collegati ad un unico centro catalitico fatto di ioni rodio (RH) attraverso una molecola “ponte” che promuove il trasferimento di elettroni dai centri RU al catalizzatore RH, dove l’idrogeno viene prodotto.
I ricercatori hanno quindi confrontato le prestazioni relative alla produzione di idrogeno ed hanno analizzato le proprietà fisiche delle supramolecole, come descritto nell’articolo pubblicato nell’edizione online del 1° giugno sulla rivista Journal of the American Chemical Society, per capire perché il fotocatalizzatore con sei assorbitori di luce a differenza di quello con tre assorbitori di luce RU è in grado di produrre più idrogeno rimanendo stabile per un periodo di tempo più lungo.
«Sviluppare sistemi molecolari efficienti per la produzione di idrogeno è difficile perché i processi si verificano a ritmi diversi», scrive l’autore principale dello studio Gerald Manbeck, chimico del gruppo che si occupa della fotosintesi artificiale presso il Brookhaven Lab.
Le sfide e le difficoltà incontrate dai ricercatori
Una delle sfide maggiori è limitare lo spreco di energia dovuto alla produzione di calore durante il processo di fotosintesi.
Un’altra complicazione è dovuta al fatto che sono necessari due elettroni per produrre ogni molecola di idrogeno. Affinché avvenga la catalisi, il sistema deve essere in grado di mantenere il primo elettrone abbastanza a lungo in modo che sia possibile utilizzare il secondo elettrone. «Abbiamo costruito supramolecole composte da più assorbitori di luce in grado di funzionare in maniera del tutto indipendente, questo ci ha permesso di aumentare la probabilità di utilizzare ogni elettrone in maniera produttiva e di migliorare la capacità delle molecole di funzionare in condizioni di scarsa luminosità» scrive Manbeck.
Manbeck ha iniziato a progettare supramolecole presso il Virginia Tech nel 2012 con Karen Brewer, coautore e suo tutor dopo il dottorato. Manbeck ha scoperto che il sistema a quattro metalli (tetrametallico) con tre centri assorbitori di luce RU e un centro catalitico RH ha prodotto solo 40 molecole di idrogeno per ogni molecola del catalizzatore e ha smesso di funzionare dopo circa quattro ore. In confronto, il sistema a sette metalli (eptametallico) sistema con sei centri RU e un centro RH è stato oltre sette volte più efficiente, ha funzionato per 300 volte producendo idrogeno per 10 ore. Questa grande disparità tra il sistema tetrametallico e quello eptametallico nell’efficienza e nella stabilità è stata sconcertante poiché le supramolecole contengono componenti molto simili.
Manbeck ha iniziato a lavorare presso il laboratorio Brookhaven nel 2013 e da quel momento ha effettuato una serie di esperimenti con il coautore Etsuko Fujita, leader del gruppo che studia la fotosintesi artificiale, per comprendere le cause fondamentali della differenza di prestazioni.
«Una supramolecola potrebbe essere un buon fotocatalizzatore, un indicatore parziale di questa caratteristica è rappresentato dalla capacità o meno da parte della molecola di formare lo stato di separazione della carica elettrica. Tuttavia realizzare la separazione efficiente della carica richiede una sintonizzazione fine dell’energia di ogni componente» sostiene Fujita. «Per promuovere la catalisi, il catalizzatore RH deve avere un livello energetico abbastanza basso in modo da accettare gli elettroni provenienti dagli assorbitori di luce RU quando quest’ultimi vengono esposti alla luce».
Attraverso la voltammetria ciclica, una tecnica elettrochimica che mostra i livelli di energia all’interno di una molecola, gli scienziati hanno scoperto che il catalizzatore RH del sistema eptametallico è leggermente più povero di elettroni e quindi più ricettivo nel ricevere elettroni rispetto alla sua controparte nel sistema tetrametallico. Questo risultato ha suggerito che il trasferimento della carica fosse favorevole nel sistema eptametallico ma non nel sistema tetrametallico.
I ricercatori hanno verificato la loro ipotesi con una tecnica denominata spettroscopia laser di assorbimento transitorio a risoluzione di nanosecondi, in cui una molecola è promossa verso uno stato eccitato da un intenso impulso laser e il decadimento dallo stato eccitato è misurato con il trascorrere del tempo. Gli spettri risultanti hanno rivelato la presenza di un trasferimento di carica da RU a RH soltanto nel sistema di eptametallico.
«I dati non solo hanno confermato le nostra ipotesi ma hanno anche rivelato che la separazione della carica nello stato eccitato si verifica molto più rapidamente di quanto ipotizzato precedentemente» scrive Manbeck. «In realtà, la migrazione della carica avviene più velocemente rispetto alla risoluzione temporale del nostro strumento e probabilmente coinvolge stati eccitati ad alta energia di breve durata». I ricercatori sono alla ricerca di un partner con strumentazione più veloce in grado di misurare il tasso esatto di separazione della carica per contribuire a chiarire il meccanismo.

In un esperimento di follow-up, gli scienziati hanno effettuato la misura transitoria di assorbimento in condizioni di funzionamento fotocatalitiche attraverso l’impiego di un reagente utilizzato come ultima sorgente finale di elettroni per produrre idrogeno (una fotosintesi artificiale scalabile di combustibile idrogeno dall’acqua richiederebbe la sostituzione del reagente con gli elettroni rilasciati durante l’ossidazione dell’acqua).
In un esperimento di follow-up, gli scienziati hanno effettuato la misura transitoria di assorbimento in condizioni di funzionamento fotocatalitiche attraverso l’impiego di un reagente utilizzato come ultima sorgente finale di elettroni per rodurre idrogeno (una fotosintesi artificiale scalabile di combustibile idrogeno dall’acqua richiederebbe la sostituzione del reagente con gli elettroni rilasciati durante l’ossidazione dell’acqua).
Lo stato eccitato, generato dall’impulso del laser, ha accettato rapidamente un elettrone dal reagente. Gli scienziati hanno scoperto che l’elettrone aggiunto risiede soltanto nel sistema eptametallico RH, questa caratteristica sostiene ulteriormente l’espansione della carica verso RH prevista dalla voltammetria ciclica.
Scenari
«L’elevato ricambio fotocatalitico del sistema eptametallico e i principi che disciplinano la separazione della carica scoperti in questo lavoro favoriranno la nascita di ulteriori studi attraverso l’utilizzo di unità multiple di raccolta della luce legate a singoli siti catalitici» scrive Manbeck.
La produzione sostenibile di idrogeno attraverso la fotosintesi è ancora lontana tuttavia, i risultati ottenuti dai ricercatori americani potrebbero aver aggiunto un tassello importante al filone di ricerca sui sistemi supramolecolari per la fotosintesi artificiale e ispirare così il lavoro di altri chimici.

