Il comportamento sociale dell’H2O
L’acqua è essenziale per la vita. Tanto essenziale che Albert Szent-Györgyi, il padre della moderna biochimica, una volta commentò: “La vita è acqua che danza sulla musica dei solidi.” Senza questa danza, non potrebbe esserci vita. Data la centralità dell’acqua, si potrebbe presumere che noi, nel XXI secolo, sappiamo più o meno tutto quello che c’è da sapere a riguardo. Ormai dovremmo già avere tutte le risposte. Eppure, in realtà, sappiamo molto poco di questa sostanza familiare e onnipresente.
Consideriamo cosa ha da dire in merito il Dott. Philip Ball, uno dei principali scrittori scientifici della nostra epoca, autore di H2O: A Biography of Water e consulente di vecchia data per la rivista Nature. Queste le parole (di Ball):
“Nessuno capisce davvero l’acqua. È imbarazzante da ammettere, ma la sostanza che riveste due terzi del nostro pianeta è tuttora un mistero. Peggio ancora, più investighiamo e più sono i problemi che si accumulano: le nuove tecniche che approfondiscono l’architettura molecolare dell’acqua allo stato liquido non fanno che sollevare nuovi enigmi.” (1)
 La molecola d’acqua, di per sé, è stata compresa piuttosto bene. Gay-Lussac e von Humboldt definirono la sua natura essenziale appena due secoli fa, e oggi si conoscono anche i dettagli della sua architettura. Essenzialmente, la molecola d’acqua è formata da due atomi di idrogeno e un atomo di ossigeno, disposti in una configurazione che probabilmente avrete già visto sui libri di scuola (fig. 1).
La molecola d’acqua, di per sé, è stata compresa piuttosto bene. Gay-Lussac e von Humboldt definirono la sua natura essenziale appena due secoli fa, e oggi si conoscono anche i dettagli della sua architettura. Essenzialmente, la molecola d’acqua è formata da due atomi di idrogeno e un atomo di ossigeno, disposti in una configurazione che probabilmente avrete già visto sui libri di scuola (fig. 1).
Sappiamo ancora troppo poco sul modo in cui questa molecola interagisce con altre molecole d’acqua o con molecole di tipo diverso. Sono in pochi, al di fuori degli esperti, a porsi interrogativi di questa natura. Per molti è sufficiente sapere che le molecole d’acqua in qualche modo si legano ad altre molecole d’acqua. Tutto qui. I biologi, per esempio, considerano spesso l’acqua come il vasto mare molecolare in cui si immergono le importanti molecole della vita.
Noi in effetti non ci raffiguriamo le molecole d’acqua che interagiscono, eppure le molecole d’acqua devono interagire. Pensate alla semplice goccia d’acqua: di tutti i fantastiliardi di molecole che compongono la goccia, alcune devono per forza aderire alle altre, perché senza coesione non potrebbe esserci la goccia.
Queste interazioni coesive non possono essere statiche: devono necessariamente modificarsi quando due gocce si uniscono, e devono modificarsi quando una goccia si spande su di una superficie. Neanche la semplice goccia può essere compresa se prima non si capisce il funzionamento delle interazioni acqua-acqua. Dunque ci chiediamo: qual è la natura di queste interazioni?
Misteri quotidiani
Quelle che seguono sono 15 osservazioni tratte dalla vita quotidiana. Sareste in grado di spiegarle? [Questi interrogativi sono discussi nel libro del Dott. Gerald H. Pollack, The Fourth Phase of Water, Red.]
• Sabbia bagnata e sabbia asciutta. Quando camminiamo sulla sabbia asciutta, i nostri piedi sprofondano, ma difficilmente succede sulla sabbia bagnata vicino al bagnasciuga. La sabbia bagnata è soda, tanto che la si può usare per costruire robusti castelli o sculture di sabbia. Evidentemente, l’acqua funge da adesivo. Ma come fa esattamente l’acqua a tenere insieme queste particelle di sabbia?
• Le onde dell’oceano. In genere le onde si dissolvono dopo aver percorso una distanza relativamente breve. Tuttavia, le onde degli tsunami sono in grado di circumnavigare la Terra varie volte prima di esaurirsi. Come fanno a mantenersi per distanze tanto immense?
• Il dolce di gelatina. I dolci di gelatina sono composti prevalentemente da acqua. Considerata tutta l’acqua che contengono, ci si aspetterebbe numerose fuoriuscite (fig. 2) e invece non ce ne sono. Persino nelle gelatine composte al 99,95% da acqua,(2) non si vede uscire neanche una goccia. Com’è possibile?
• Pannolini. Analogamente alla gelatina, i pannolini riescono a contenere moltissima acqua: più del 50% del loro peso in urina e 800 volte il loro peso in acqua pura. Come fanno a trattenere così tanti liquidi?
• La scivolosità del ghiaccio. In genere i materiali solidi non scivolano tanto facilmente l’uno sull’altro. Pensate a come le scarpe si piantano su una strada in salita: l’attrito vi impedisce di scivolare. Se la salita è ghiacciata, però, dovete fare moltissima attenzione per evitare di cadere rovinosamente. Perché il ghiaccio si comporta in modo tanto diverso dalla maggior parte dei solidi?
• Gonfiore. Una vostra amica si rompe una caviglia durante una partita di tennis. In un paio di minuti la caviglia si gonfia fino a raddoppiare di dimensioni. Perché l’acqua affluisce così rapidamente alla zona infortunata?
• L’acqua calda che si congela. Un precoce studente di scuola media una volta osservò uno strano fenomeno durante la lezione di cucina. Usando un preparato per gelati in polvere, riusciva a produrre il suo dessert più velocemente se aggiungeva acqua calda anziché acqua fredda. Questa osservazione paradossale diventò famosa. Com’è possibile che l’acqua calda si congeli più rapidamente dell’acqua fredda?
• L’acqua che sale. Le foglie sono assetate. Per poter integrare nelle piante e negli alberi i liquidi che si perdono attraverso l’evaporazione, l’acqua scorre dalle radici verso l’alto attraverso sottili colonnine. La spiegazione comune sostiene che dal punto superiore delle colonne si eserciti una forza di trazione sull’acqua sospesa al di sotto. Ciò, però, in una sequoia alta 100 metri, è problematico: il peso dell’acqua ammassata in ogni capillare sarebbe sufficiente a rompere la colonnina che, una volta rotta, non potrebbe più portare l’acqua dalle radici verso l’alto. Come fa la natura a evitare questo inconveniente?
• Il cemento che si spacca. Nei marciapiedi di cemento a volte si formano degli squarci dovuti alle radici degli alberi che crescono verso l’alto. Le radici sono formate principalmente da acqua. Com’è possibile che le radici contenenti acqua possano esercitare una pressione sufficiente a spaccare delle lastre di cemento?
• Le goccioline sulle superfici. Le gocce d’acqua si disseminano come perline su alcune superfici mentre si spandono su altre. Il grado di espansione è infatti usato come criterio per classificare le diverse superfici. Il fatto che si assegni una classificazione, però, non spiega perché le gocce si spandano e perché lo facciano a livelli diversi. Quali sono le forze che fanno spandere le gocce d’acqua?
• Camminare sulle acque. Magari avrete visto dei video di lucertole che camminano sulla superficie degli stagni: questi rettili riescono a scorazzare da una sponda all’altra. Come spiegazione plausibile viene in mente l’elevata tensione superficiale dell’acqua; tuttavia se questa riguardasse solo i pochi strati molecolari più alti in superficie, la tensione dovrebbe essere debole. Che cosa c’è nell’acqua (o nella lucertola) che rende possibile questa impresa quasi biblica?
• Nubi isolate. Dalle vaste e ininterrotte distese delle acque oceaniche si solleva il vapore acqueo. Questo vapore dovrebbe essere dappertutto. Eppure, spesso, le soffici nuvole bianche si formano come entità separate, che punteggiano un cielo altrimenti azzurro e sgombro (fig. 3). Qual è la forza che indirizza il vapore diffuso che sale dall’acqua verso questi siti specifici?
• Articolazioni che stridono. Piegare il ginocchio fino in fondo in genere non produce scricchiolii. Infatti c’è dell’acqua che lubrifica ottimamente le ossa in contatto fra loro (o meglio, gli strati di cartilagine che rivestono le ossa). Ma allora quale caratteristica dell’acqua crea quella leggera frizione?
• Ghiaccio galleggiante. La maggior parte delle sostanze si contrae quando si raffredda. Anche l’acqua si contrae… fino ai 4 °C. Al di sotto di questa temperatura critica, l’acqua inizia a espandersi, e continua a farlo fino a diventare ghiaccio. Ecco perché il ghiaccio galleggia. Cosa c’è di speciale nei 4 °C, e perché il ghiaccio è significativamente meno denso dell’acqua?
• La consistenza dello yogurt. Come fa lo yogurt ad avere una consistenza così compatta?
Misteri dal laboratorio
Ora considererò alcune semplici osservazioni di laboratorio, a partire da quella notata da alcuni studenti che si sono precipitati da me di corsa per farmi vedere cos’avevano scoperto.
 • Le microsfere migranti
• Le microsfere migranti
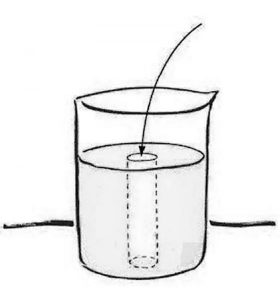
I miei studenti hanno condotto un semplice esperimento. Hanno gettato una manciata di minuscole sfere, note come microsfere, in un becher d’acqua, hanno agitato la sospensione per favorire il giusto mescolamento, coperto il becher per ridurre al minimo l’evaporazione e poi sono tornati a casa a dormire.
Secondo il pensiero convenzionale, non sarebbe dovuto succedere null’altro, a parte forse un po’ di sedimentazione in fondo al becher. La sospensione sarebbe dovuta apparire uniformemente opaca, come quando si versano delle gocce di latte nell’acqua e si agita vigorosamente la miscela.
La sospensione in effetti appariva uniformemente opaca… per la maggior parte. Però, vicino al centro del becher (guardando dall’alto), si era formata inesplicabilmente una colonna limpida (fig. 4).
La trasparenza indicava che la colonna non conteneva microsfere. Una forza misteriosa aveva allontanato le microsfere dal centro, convogliandole verso la periferia del becher. Poi, mantenendo le condizioni iniziali all’interno di una finestra ben definita, queste colonne limpide si ripresentavano sistematicamente: siamo riusciti a riprodurle molte altre volte.(3)
La domanda: che cosa induce questa migrazione controintuitiva delle sfere lontano dal centro?
 • Il ponte fatto d’acqua
• Il ponte fatto d’acqua
Un altro curioso fenomeno di laboratorio, il cosiddetto “ponte d’acqua”, si crea quando due becher distanziati sono collegati da una striscia d’acqua: riuscite a immaginarlo?
Anche se il ponte d’acqua è una curiosità nota da secoli, il Dott. Elmar Fuchs e i suoi colleghi ne hanno esplorato una variabile che ha suscitato interesse in tutto il mondo.
La dimostrazione inizia riempiendo d’acqua i due becher quasi fino all’orlo e poi avvicinandoli, con i beccucci che si toccano. Un elettrodo immerso in ciascun becher crea una differenza di potenziale dell’ordine dei 10 kV. Immediatamente, l’acqua di un becher salta all’orlo e crea un ponte con l’altro becher.
Una volta formato il ponte, è possibile separare lentamente i due becher. Il ponte non si rompe: continua ad allungarsi, colmando lo spazio fra i due becher anche quando vengono separati di vari centimetri (fig. 5).
Sorprendentemente, il ponte d’acqua non gocciola quasi mai: presenta una rigidità quasi di ghiaccio, anche se l’esperimento è svolto a temperatura ambiente. Vi invito a resistere alla tentazione di provare voi stessi questo esperimento ad alta tensione a meno che vi consideriate immuni agli shock elettrici. Meglio guardare un video di questo incredibile fenomeno.(w1)
La domanda: che cosa sostiene questo ponte fatto d’acqua?
 • La goccia d’acqua galleggiante
• La goccia d’acqua galleggiante
L’acqua dovrebbe mescolarsi istantaneamente con l’acqua. Eppure, se fate uscire delle gocce d’acqua da un tubicino stretto posizionato appena sopra un piatto di acqua, queste gocce spesso galleggeranno per un certo tempo sulla superficie dell’acqua prima di dissolversi (fig. 6). A volte le gocce riescono a sostenersi per decine di secondi.
Ancor più paradossale: le gocce non si dissolvono nell’acqua sottostante attraverso singoli eventi unitari, ma in una successione di spruzzi.(4) Sembra quasi una danza programmata.
Le gocce d’acqua galleggianti si possono vedere anche in natura: basta sapere dove guardare. Un buon momento è dopo un acquazzone, quando l’acqua gocciola da un ripiano sopra una pozzanghera, o dalla punta di una barca sulla superficie del lago. Persino le gocce di pioggia a volte galleggiano quando atterrano direttamente sull’acqua. La domanda è evidente: se l’acqua si mescola naturalmente con l’acqua, allora che cos’è che a volte ne ritarda la naturale aggregazione?
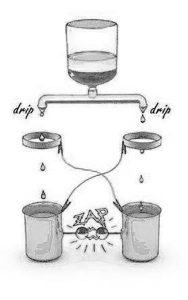
• La scarica di Lord Kelvin
Infine, la fig. 7 rappresenta un’ulteriore osservazione che desta perplessità. L’acqua che gocciola da una bottiglia capovolta o da un normale rubinetto viene separata in due rami. Le gocce cadono da ciascun ramo passando attraverso degli anelli di metallo per poi finire in contenitori metallici.
Gli anelli e i contenitori sono collegati con fili elettrici incrociati, come si vede nella figura. Delle sferette di metallo poste l’una davanti all’altra, e separate da uno spazio di alcuni millimetri, sporgono da asticelle metalliche legate a ciascun contenitore.
Questo esperimento, concepito in origine da Lord Kelvin, produce un risultato sorprendente. Dopo che un certo numero di gocce è già sceso, si inizia a udire un suono crepitante. Poi, subito dopo, nello spazio vuoto fra le sferette si forma una scarica che produce un lampo, accompagnata da un “crac” udibile. La scarica elettrica può verificarsi solo se fra i due contenitori si accumula una forte differenza di potenziale elettrico. Questa differenza di potenziale può raggiungere facilmente i 100.000 volt, a seconda delle dimensioni dello spazio vuoto.
Eppure, la forte separazione di carica necessaria a creare questa differenza di potenziale si accumula da una singola sorgente d’acqua.
Sebbene sia possibile costruire uno di questi particolari marchingegni in casa, è molto più semplice osservare la scarica in un video.(w2)
Un ottimo esempio è quello fornito dal Prof. Walter Lewin, che dimostra la produzione, il verificarsi della scarica davanti a una classe di matricole esterrefatte del MIT.(w3)
Poi invita gli studenti a spiegare il fenomeno, come compito a casa. E voi, sapreste spiegare come una singola sorgente d’acqua può produrre una separazione di carica tanto forte?
Cosa insegnano questi misteri
I fenomeni presentati nelle sezioni precedenti non si prestano a spiegazioni semplici. Anche i più importanti studiosi dell’acqua che conosco non riescono a trovare risposte soddisfacenti: molti non sanno neppure andare oltre le spiegazioni più superficiali. Evidentemente nel nostro contesto interpretativo manca qualcosa, altrimenti i fenomeni sarebbero immediatamente spiegabili, mentre invece non lo sono.
Vorrei ribadire che non stiamo trattando l’acqua a livello molecolare, ma stiamo considerando un numero altissimo di molecole d’acqua. Oggi non conosciamo ancora le interazioni delle molecole d’acqua fra di loro: il comportamento “sociale” dell’acqua. ∞
Note
1. Ball, Philip, H2O: A Biography of Water, Weidenfeld & Nicholson, 1999
2. Osada, Y. e Gong, J., “Stimuliresponsive polymer gels and their application to chemomechanical systems”, Prog. Polym. Sci. 1993; 18:187-226
3. Ovchinnikova, K. e Pollack, G.H., “Cylindrical phase separation in colloidal suspensions”, Phys. Rev. E. 2009; 79(3), 036117
4. Klyuzhin, I.S., Ienna, F., Roeder, B., Wexler, A. e Pollack, G.H., “Persisting water droplets on water surfaces”, J. Phys. Chem. B 2010; 114:14020-7
w1. tinyurl.com
w2. tinyurl.com
w3. tinyurl.com
L’autore:
Il Dott. Ric. Gerald H. Pollack è professore di bioingegneria all’Università di Washington-Seattle, dove gestisce il Pollack Laboratory. È caporedattore della rivista scientifica interdisciplinare WATER (cfr. waterjournal.org). Pollack ha ricevuto vari premi e riconoscimenti ed è uno dei principali ricercatori internazionali sull’acqua. Può essere contattato all’indirizzo ghp@u.washington.edu.
Nota di redazione (Nexus):
Questo articolo è tratto dai capitoli 1 e 2 del libro di Gerald H. Pollack The Fourth Phase of Water: Beyond Solid, Liquid, and Vapor (Ebner & Sons Publishers, Seattle, 2013; disponibile sul sito ebnerandsons.com).